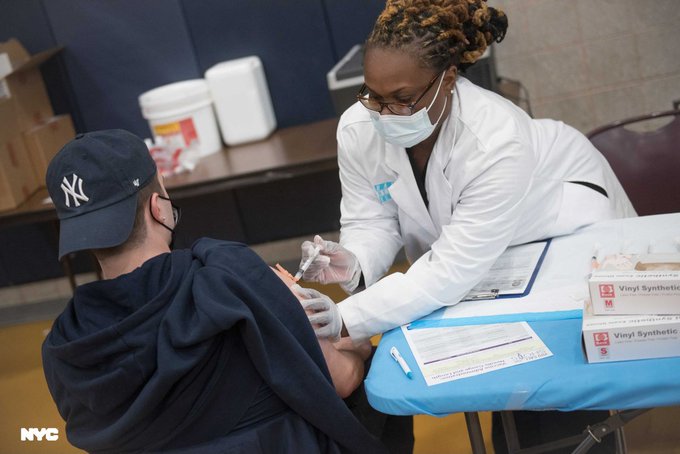
Estados Unidos comenzó este miércoles a administrar la vacuna contra el COVID-19 a niños de entre 5 y 11 años, luego de que cerca de 28 millones de menores de edad han sido incluidos entre la población que puede recibir las inyecciones que protegen contra la enfermedad.
CDC accepted the Advisory Committee on Immunization Practices’ (ACIP) recommendation that children ages 5–11 be vaccinated against #COVID19.
The COVID-19 vaccine authorized for this group is over 90% effective at preventing COVID-19.
More: https://t.co/cX2X5nMns7
— CDC (@CDCgov) November 3, 2021
Ayer, los Centros para el Control y la Prevención de Enfermedades de Estados Unidos (CDC) recomendaron la vacuna de Pfizer/BioNTech para su uso generalizado en ese grupo poblacional, después de que su panel de asesores emitiera una recomendación al respecto.
Si bien alrededor del 58% de los estadounidenses han completado su esquema de vacunación contra el COVID-19, los menores de 12 años aún no han podido ser inoculados. La variante Delta del virus ha provocado la hospitalización de miles de niños, que constituyen el 25% de los casos en el país.
La vacuna, que ha demostrado una eficacia superior al 90% en la prevención de la infección sintomática en los niños, ofrece una vía para reducir las cuarentenas o el cierre de escuelas y aumentar las libertades.
“Ha habido una gran expectación por parte de los padres en torno a la autorización de las vacunas para nuestros hijos”, dijo el lunes la directora de los CDC, Rochelle Walensky. “Comprendo profundamente la urgencia y la preocupación por ofrecer la mejor protección a nuestros niños contra el virus”, añadió.
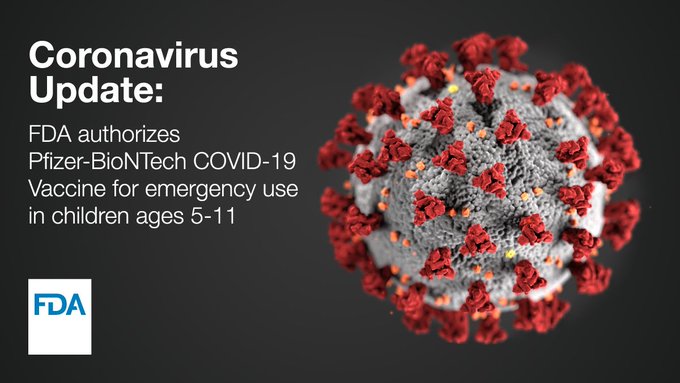
La Administración de Alimentos y Medicamentos de Estados Unidos (FDA) autorizó el viernes la vacuna de Pfizer/BioNTech para niños de 5 a 11 años
El gobierno de Estados Unidos comenzará a enviar 15 millones de vacunas contra el COVID-19 para niños esta semana a los centros de distribución de todo el país, y se espera que el programa pediátrico esté funcionando a plenitud la próxima semana.
Una vez que se entreguen las vacunas, en lugar de los centros de vacunación masiva, la distribución se basará en las consultas de pediatras, hospitales infantiles y farmacias, señaló La Casa Blanca.
El gobierno federal ha comprado 50 millones de dosis de la vacuna de Pfizer para la campaña de vacunación y tiene suficiente suministro para los 28 millones de niños que pueden recibirlas, afirmaron funcionarios estadounidenses esta semana.
La vacuna de Pfizer para los más pequeños contiene una dosis de 10 microgramos, menos que la de 30 microgramos que se administra a los mayores de 12 años.