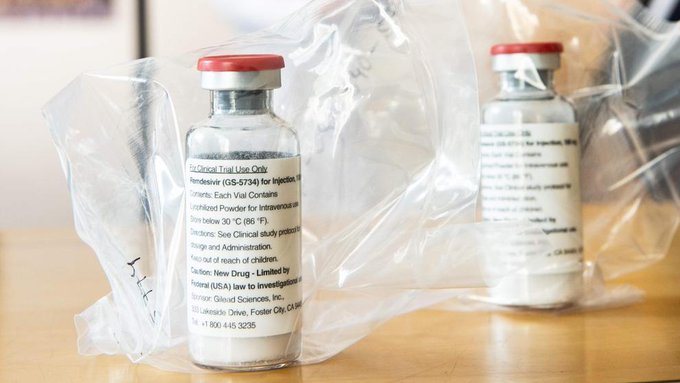
La Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) emitió una alerta sobre la comercialización ilegal y falsificación de Remdesivir, el tratamiento que se usa para la atención de pacientes con COVID-19, que hasta ahora es de uso exclusivo de instituciones públicas del gobierno federal y estatal que conforman el Sistema Nacional de Salud y de alta especialidad.
Indicó que luego de una alerta emitida en julio de 2021, se detectó la falsificación de cuatro nuevos lotes de remdesivir: EN2005A2-B, EN2009D7-Q, CM2022F5 y CA2023G5, además de que se identificaron productos con denominaciones distintivas como Corovir, Bemsivir, Desrem y Remdesivir, que no están autorizados para su comercialización y distribución en México.
“El riesgo de consumir medicamentos ilegales y falsificados radica en la falta de pruebas sobre la seguridad de sus ingredientes, inocuidad de su elaboración, así como el correcto almacenaje y distribución. Por lo anterior, Cofepris recomienda no comprar fármacos que son de uso de emergencia y/o cualquier otro que se comercialice de manera irregular”, indicó la Comisión.
La Cofepris compartió algunas de las características del producto falsificado para que la ciudadanía pudiera identificarlo: tapón color azul y grabado; leyendas y tipografía no autorizada para México; presentación en sustancia líquida y lotes no utilizados por Gilead Sciences.
Hizo un llamado a los distribuidores autorizados, personal médico, clínicas y hospitales públicos que cuenten con stock de Remdesivir para que verifiquen que no se traten de los lotes citados y, de contar con dichos lotes irregulares, se suspenda de manera inmediata el suministro y presentar la denuncia correspondiente ante la Cofepris.
Recordemos que el Remdesivir fue aprobado en marzo de 2021 por la autoridad sanitaria, bajo el esquema de uso de emergencia, es decir, sólo podrá suministrarse de forma gratuita en las instituciones públicas que conforman el Sistema Nacional de Salud y alta espacialidad.